2024年11月12日�,國家藥監(jiān)局發(fā)布《種植用口腔骨填充材料注冊審查指導(dǎo)原則(征求意見稿)》�,本指導(dǎo)原則是對種植用口腔骨填充材料注冊申報(bào)資料的一般要求,醫(yī)療器械注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用�。依據(jù)《醫(yī)療器械分類目錄》,種植用口腔骨填充材料產(chǎn)品為第三類醫(yī)療器械注冊產(chǎn)品�,分類編碼:17-08-06。本文為大家介紹種植用口腔骨填充材料產(chǎn)品技術(shù)要求及注冊審查要點(diǎn)�。
2024年11月12日,國家藥監(jiān)局發(fā)布《種植用口腔骨填充材料注冊審查指導(dǎo)原則(征求意見稿)》�,本指導(dǎo)原則是對種植用口腔骨填充材料注冊申報(bào)資料的一般要求,醫(yī)療器械注冊申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用�。依據(jù)《醫(yī)療器械分類目錄》,種植用口腔骨填充材料產(chǎn)品為第三類醫(yī)療器械注冊產(chǎn)品�,分類編碼:17-08-06�。本文為大家介紹種植用口腔骨填充材料產(chǎn)品技術(shù)要求及注冊審查要點(diǎn)。
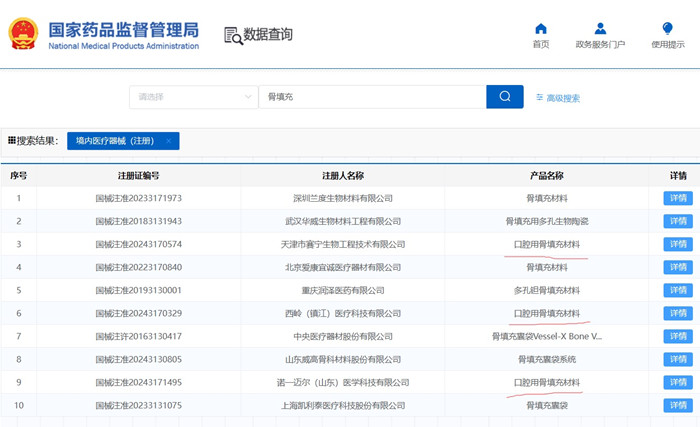
一�、種植用口腔骨填充材料產(chǎn)品注冊單元劃分的原則
產(chǎn)品注冊單元的劃分需符合《醫(yī)療器械注冊單元劃分指導(dǎo)原則》的要求。醫(yī)療器械產(chǎn)品的注冊單元原則上以技術(shù)原理�、結(jié)構(gòu)組成、性能指標(biāo)和適用范圍為劃分依據(jù)�。對于原材料來源不同時(shí)�,需劃分為不同的注冊單元;產(chǎn)品結(jié)構(gòu)組成或加工處理方式不同而導(dǎo)致產(chǎn)品性能指標(biāo)不同時(shí)�,原則上劃分為不同注冊單元�。
例如,原材料來源于不同的生物種類時(shí)�,如牛骨�、豬骨來源的產(chǎn)品,需劃分為不同的注冊單元�;對于同種生物來源,組織來源不同時(shí)�,如牛股骨�、牛肋骨組織來源�,需劃分為不同的注冊單元�;對于同種生物來源,制備工藝不同的�,如經(jīng)材料改性處理與未經(jīng)改性處理等�,需劃分為不同的注冊單元�。
二 、種植用口腔骨填充材料產(chǎn)品操作原理描述
闡述產(chǎn)品的原材料(動物源性產(chǎn)品應(yīng)明確其組織類型�、取材部位�、種屬、地理來源�、年齡等)、結(jié)構(gòu)及組成�、使用方法及圖示�、配合使用器械等,提供產(chǎn)品整體/局部結(jié)構(gòu)示意圖(如粉體的粒徑大小�、塊體的形狀尺寸等)�、掃描電鏡照片(如表面結(jié)構(gòu)、孔隙特性)�、產(chǎn)品降解信息(包括降解機(jī)理�、降解產(chǎn)物、預(yù)期降解時(shí)間)�,明確產(chǎn)品的交付狀態(tài)�、滅菌方式、無菌有效期。闡述產(chǎn)品的預(yù)期用途�、工作原理或作用機(jī)理�。
2.1產(chǎn)品的適用范圍和禁忌證
產(chǎn)品的適用范圍、適用人群�、禁忌證需與申報(bào)產(chǎn)品的性能、功能相符�。
2.2適用范圍
適用范圍的表述需客觀�、清晰,使用有明確定義或行業(yè)公認(rèn)的術(shù)語或名詞�。例如:產(chǎn)品與屏障膜聯(lián)合使用,適用于口腔科手術(shù)的骨缺損修復(fù)�,包括:拔牙后及殘根拔除術(shù)后拔牙窩填充�、牙槽嵴恢復(fù)。
三�、種植用口腔骨填充材料產(chǎn)品技術(shù)要求的主要性能指標(biāo)
種植用口腔骨填充材料產(chǎn)品技術(shù)要求需符合相關(guān)國家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)和有關(guān)法律�、法規(guī)的相應(yīng)要求�。在此基礎(chǔ)上,注冊申請人需根據(jù)產(chǎn)品的特點(diǎn)�,制定確保產(chǎn)品安全�、有效的技術(shù)要求。產(chǎn)品技術(shù)要求中試驗(yàn)方法需依據(jù)有關(guān)國家標(biāo)準(zhǔn)�、行業(yè)標(biāo)準(zhǔn)�、國際標(biāo)準(zhǔn)制訂,或經(jīng)過驗(yàn)證�。
3.1產(chǎn)品型號/規(guī)格及其劃分的說明
列表說明產(chǎn)品的型號、規(guī)格�,明確產(chǎn)品型號�、規(guī)格的劃分說明。
3.2性能指標(biāo)
3.2.1物理和機(jī)械性能指標(biāo)
3.2.1.1 外觀�。
3.2.1.2 規(guī)格裝量�。對于粉狀產(chǎn)品,需要明確產(chǎn)品的粒徑范圍�、裝量及公差;對于塊狀產(chǎn)品�,需要明確其尺寸及公差�,對于特殊形狀或結(jié)構(gòu)所涉及的其他尺寸及公差要求,注意避免出現(xiàn)型號規(guī)格交疊�。
3.2.1.3 密度�。
3.2.1.4 結(jié)構(gòu)特征(如適用)。包含孔隙率�、孔徑大小、孔徑分布等�。
3.2.1.5 力學(xué)性能(如適用)。對于塊狀等具有一定形狀的產(chǎn)品�,提供力學(xué)性能(如抗壓強(qiáng)度�、各向異性等)。
3.2.2化學(xué)性能指標(biāo)
3.2.2.1 晶相分析(如適用)�。包括相成分�、含量、結(jié)晶度�。
3.2.2.2 鈣磷原子比�。
3.2.2.3 紅外吸收光譜。
3.2.2.4 酸堿度�。
3.2.2.5 水分含量或干燥失重�。
3.2.2.6 重金屬(以Pb計(jì))。
3.2.2.7 微量元素含量�。包括砷�、鎘、汞�、鉛等元素含量,如必要(例如工藝等環(huán)節(jié)中引入的其他元素)需開展更多的元素定量檢測�。
3.2.2.8 有機(jī)相含量的測定(如適用)�。例如:雜蛋白含量、脂肪含量等�。
3.2.2.9 添加物或助劑殘留量�。
3.2.3其他指標(biāo)
3.2.3.1 無菌。
3.2.3.2 環(huán)氧乙烷殘留量(如適用)�。
四�、種植用口腔骨填充材料產(chǎn)品注冊審查要點(diǎn)
1.種植用口腔骨填充材料產(chǎn)品注冊檢驗(yàn)報(bào)告及典型性產(chǎn)品確定原則
醫(yī)療器械注冊申請人需提供符合醫(yī)療器械注冊申報(bào)法規(guī)文件要求的檢驗(yàn)報(bào)告�。若申報(bào)的產(chǎn)品包括多個(gè)型號,同一注冊單元內(nèi)所檢驗(yàn)的產(chǎn)品應(yīng)當(dāng)能夠代表本注冊單元內(nèi)其他產(chǎn)品的安全性和有效性�、涵蓋所有的性能指標(biāo)�,并提供典型性檢驗(yàn)樣品的確定依據(jù)。
2.種植用口腔骨填充材料產(chǎn)品體外降解性能研究�。
提交產(chǎn)品完全降解或降解至穩(wěn)態(tài)的體外降解研究�,可參照GB/T 16886.14《醫(yī)療器械生物學(xué)評價(jià)第14部分:陶瓷降解產(chǎn)物的定性與定量》對產(chǎn)品降解的適用性開展研究,若開展體外降解試驗(yàn)�,需模擬產(chǎn)品臨床預(yù)期植入環(huán)境�,評價(jià)產(chǎn)品的降解速率、降解各時(shí)間點(diǎn)性能變化以及降解產(chǎn)物�,分析產(chǎn)品降解速率及降解產(chǎn)物對微環(huán)境的影響,結(jié)合臨床預(yù)期用途�,論述產(chǎn)品滿足臨床需求。提供降解周期及各觀察時(shí)間點(diǎn)的設(shè)定依據(jù)�。如降解時(shí)間長對局部組織存在影響,需結(jié)合產(chǎn)品臨床預(yù)期使用情形�,結(jié)合同類已上市產(chǎn)品降解性能論述該產(chǎn)品降解周期的可接受性�,提交與組織(包括軟組織)愈合周期、生理性骨結(jié)合骨改建周期相適應(yīng)的研究資料�。
3.種植用口腔骨填充材料產(chǎn)品生物學(xué)特性研究
生物相容性評價(jià)應(yīng)遵循GB/T 16886.1《醫(yī)療器械生物學(xué)評價(jià)第1部分:風(fēng)險(xiǎn)管理過程中的評價(jià)與試驗(yàn)》和YY/T 0268《牙科學(xué)口腔醫(yī)療器械生物學(xué)評價(jià)第1單元:評價(jià)與試驗(yàn)》相關(guān)要求�,參考《國家食品藥品監(jiān)督管理局關(guān)于印發(fā)醫(yī)療器械生物學(xué)評價(jià)和審查指南的通知》中的審查要點(diǎn)進(jìn)行風(fēng)險(xiǎn)評價(jià)�。生物學(xué)評價(jià)終點(diǎn)可參考GB/T 16886.1《醫(yī)療器械生物學(xué)評價(jià)第1部分:風(fēng)險(xiǎn)管理過程中的評價(jià)與試驗(yàn)》附錄A相關(guān)要求,一般包括細(xì)胞毒性�、致敏�、刺激或皮內(nèi)反應(yīng)(或口腔粘膜刺激試驗(yàn))、材料介導(dǎo)的致熱性�、細(xì)菌內(nèi)毒素�、急性全身毒性、亞急性毒性�、亞慢性毒性、慢性毒性�、植入反應(yīng)�、遺傳毒性和致癌性�,必要時(shí)�,開展生物學(xué)試驗(yàn)。
4.種植用口腔骨填充材料產(chǎn)品生物安全性研究
對于動物源性材料成分的產(chǎn)品�,需明確動物地理來源�、動物種類、年齡�、取材部位、組織性質(zhì)�,參照《動物源性醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則(2017年修訂版)》提供產(chǎn)品生物安全性研究資料。主要涉及原材料來源控制的安全性資料�,病毒和/或傳染性病原體的風(fēng)險(xiǎn)分析、相應(yīng)控制措施的描述及驗(yàn)證性資料�,產(chǎn)品免疫原性(免疫反應(yīng))的風(fēng)險(xiǎn)分析、控制工藝描述及驗(yàn)證性資料�。
如有種植用口腔骨填充材料產(chǎn)品注冊或是口腔用骨填充材料注冊代理服務(wù)需求,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)�,聯(lián)系人:葉工,電話:18058734169�,微信同�。