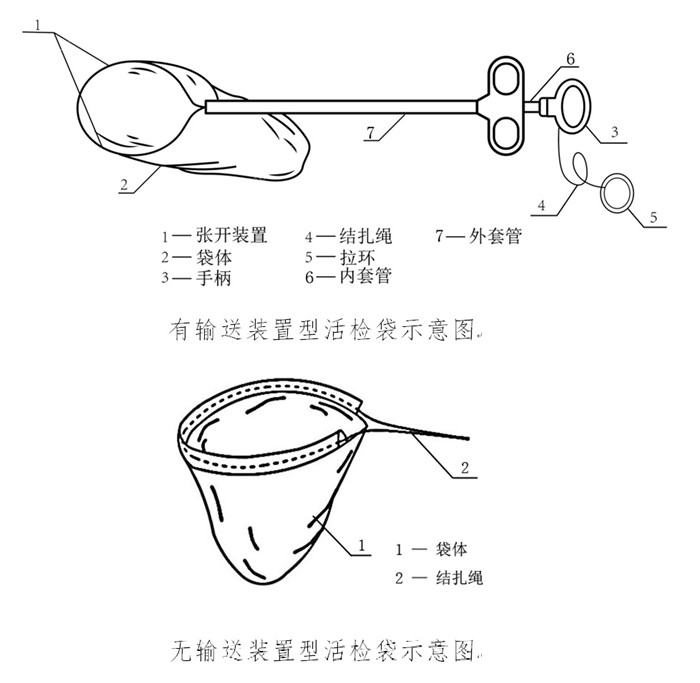
用于腔鏡手術(shù)時將活檢樣本從手術(shù)區(qū)域取出的一次性使用內(nèi)窺鏡用活檢袋����,在我國屬于第二類醫(yī)療器械注冊產(chǎn)品���。活檢袋通常分為有輸送裝置型和無輸送裝置型兩種�,產(chǎn)品通常由活檢袋套管、納物袋�����、結(jié)扎繩�����、撐開鉗構(gòu)成����。近日,國家藥監(jiān)局發(fā)布《一次性使用內(nèi)窺鏡用活檢袋注冊審查指導(dǎo)原則(征求意見稿)》���,正好借這個機會�,為大家介紹一次性使用內(nèi)窺鏡用活檢袋注冊及醫(yī)療器械生產(chǎn)許可證辦理要點�,一起看正文����。
用于腔鏡手術(shù)時將活檢樣本從手術(shù)區(qū)域取出的一次性使用內(nèi)窺鏡用活檢袋,在我國屬于第二類醫(yī)療器械注冊產(chǎn)品?;顧z袋通常分為有輸送裝置型和無輸送裝置型兩種,產(chǎn)品通常由活檢袋套管�����、納物袋�����、結(jié)扎繩����、撐開鉗構(gòu)成。近日����,國家藥監(jiān)局發(fā)布《一次性使用內(nèi)窺鏡用活檢袋注冊審查指導(dǎo)原則(征求意見稿)》,正好借這個機會����,為大家介紹一次性使用內(nèi)窺鏡用活檢袋注冊及醫(yī)療器械生產(chǎn)許可證辦理要點,一起看正文�。
一、一次性使用內(nèi)窺鏡用活檢袋注冊審查要點
注冊申報資料應(yīng)符合國家藥品監(jiān)督管理局《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》中對注冊申報資料的要求���,同時宜符合以下要求:
(一)建議
1.臨床導(dǎo)向
活檢袋設(shè)計開發(fā)應(yīng)以臨床為導(dǎo)向����,應(yīng)能保證產(chǎn)品用于臨床的安全和有效。產(chǎn)品設(shè)計開發(fā)時應(yīng)充分調(diào)研臨床需求并將其準確轉(zhuǎn)化為設(shè)計開發(fā)輸入的明確要求����,使得最終輸出的產(chǎn)品能保證用于臨床的安全和有效?����;顧z袋產(chǎn)品的臨床需求通常包括但不限于以下內(nèi)容:
活檢袋與配套器械(如腹部穿刺器等)的配合活檢袋袋口的撐開
活檢袋袋體的容積
活檢袋袋體的牢固和抗穿刺
活檢袋袋體的密封
獲取標本/異物后活檢袋的回撤
2.有害物質(zhì)的控制
活檢袋設(shè)計開發(fā)和生產(chǎn)過程應(yīng)保證產(chǎn)生的析出物(包括可瀝濾物和/或蒸發(fā)物)�、加工殘留物等降低到可接受水平,為患者提供最大程度的安全保障�����。
選擇活檢袋袋體材料時除考慮袋體的物理性能(袋體強度和抗穿刺性等)和與加工方式的相容性外還應(yīng)充分考慮其析出物(如殘留單體等)對于人體的影響并進行評價����。
應(yīng)結(jié)合活檢袋加工助劑的使用情況及采取的去除措施等對加工殘留物的水平進行充分的研究和評價。對于采用環(huán)氧乙烷滅菌的活檢袋產(chǎn)品����,環(huán)氧乙烷及二氯乙醇是其常見的加工殘留物,考慮到活檢袋產(chǎn)品通常折疊為多層結(jié)構(gòu)后再進行滅菌�����,對于環(huán)氧乙烷的擴散和解析會帶來額外的挑戰(zhàn)�,在環(huán)氧乙烷滅菌及解析過程的設(shè)計開發(fā)中均應(yīng)予以充分的考慮和驗證,確保所采用方法對殘留物具有足夠的去除能力����,保證其降低到可接受水平。
3.可用性
活檢袋的設(shè)計開發(fā)應(yīng)考慮醫(yī)療器械可用性工程的要求���。
醫(yī)療器械可用性工程是醫(yī)療器械設(shè)計開發(fā)的重要組成部分�,注冊申請人需在質(zhì)量管理體系設(shè)計開發(fā)過程的框架下�����,參考《醫(yī)療器械可用性工程注冊審查指導(dǎo)原則》相應(yīng)內(nèi)容及可用性相關(guān)標準�,建立充分、適宜����、有效的可用性工程過程?;顧z袋產(chǎn)品可識別為中�、低使用風(fēng)險醫(yī)療器械,應(yīng)基于風(fēng)險管理過程開展可用性工程全生命周期質(zhì)控工作���,開展使用錯誤評估并形成報告����,使用錯誤評估報告用于細化風(fēng)險管理報告關(guān)于可用性的內(nèi)容�,包括基本信息、使用風(fēng)險級別�、核心要素、同類醫(yī)療器械上市后使用問題分析�、使用風(fēng)險管理、結(jié)論等內(nèi)容�����。
二�、一次性使用內(nèi)窺鏡用活檢袋產(chǎn)品技術(shù)要求
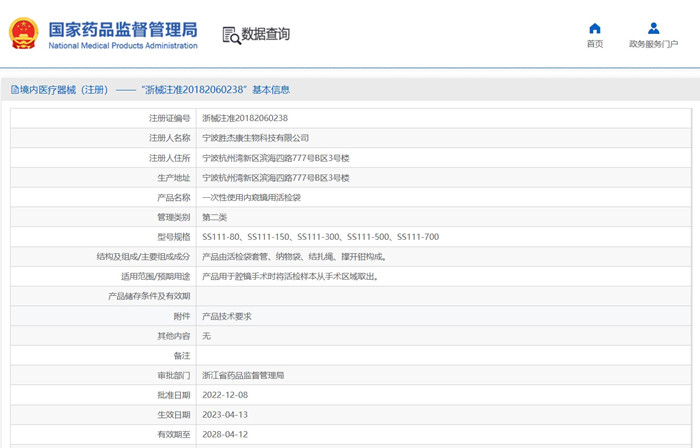
一次性使用內(nèi)窺鏡用活檢袋產(chǎn)品性能指標通常包括但不限于以下項目:外觀、尺寸(插入部分的最大寬度���、工作長度�����、袋口尺寸)���、操作性能、各使用部位的連接強度(如拉繩與袋體�、拉繩與拉環(huán)等)、拉繩的強度����、袋體接合處的連接強度、袋體密封性能�、袋體容積、耐腐蝕性(如適用)����、化學(xué)性能(澄清度和色澤、酸堿度���、重金屬�����、還原物質(zhì)�、蒸發(fā)殘渣等)���、環(huán)氧乙烷殘留量(如適用)�、無菌。
三���、一次性使用內(nèi)窺鏡用活檢袋產(chǎn)品的醫(yī)療器械生產(chǎn)許可證辦理要點
對于一次性使用內(nèi)窺鏡用活檢袋產(chǎn)品來說�,辦理醫(yī)療器械生產(chǎn)許可證的要點一是企業(yè)應(yīng)該具備符合要求的產(chǎn)品生產(chǎn)能力和質(zhì)量保證能力����,這些能力包括人機料化法測這些過程要素及公司綜合管理能力;二是企業(yè)應(yīng)按照GB/T42061-2022/ISO13485:2016《醫(yī)療器械 質(zhì)量管理體系 用于法規(guī)的要求》�、《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》、《醫(yī)療器械注冊質(zhì)量管理體系核查指導(dǎo)原則》建立公司質(zhì)量管理體系���,并持續(xù)合規(guī)運行醫(yī)療器械質(zhì)量管理體系�。
如有一次性使用內(nèi)窺鏡用活檢袋注冊或是醫(yī)療器械生產(chǎn)許可證辦理服務(wù)需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:葉工����,電話:18058734169,微信同����。